Sustancias Químicas · Clasificación

Sustancias puras son aquellas que tienen propiedades constantes clasificadas en elementos como metales y no metales que forman compuestos como óxidos, ácidos, sales, bases y compuestos orgánicos.
las sustancias puras son de dos tipos: Elementos y Compuestos. Ambos materiales son ópticamente homogéneos y mantienen sus propiedades y características. Las sustancias puras pueden cambiar de estado físico sin alterar la naturaleza o composición. A continuación la definición de cada uno de ellos:
Elementos
Un elemento químico, o solamente elemento, es una sustancia formada por átomos con el mismo número de protones en el núcleo. Este número se conoce como el número atómico del elemento. Por ejemplo, todos los átomos con 6 protones en sus núcleos son átomos del elemento químico carbono, mientras que todos los átomos con 92 protones en sus núcleos son átomos del elemento uranio. Actualmente se conocen en el mundo millones de compuestos que se encuentran de manera espontánea en la Naturaleza o que han sido creados por el hombre. Cada uno de estos compuestos es el resultado de la combinación de dos o más de estos elementos químicos.
Se conocen más de 112 elementos. Algunos son muy comunes y necesarios, como el carbono, el oxígeno o el hidrógeno. Otros, creados artificialmente en aceleradores de partículas o en reactores atómicos, son tan raros que sólo existen durante milésimas de segundo.
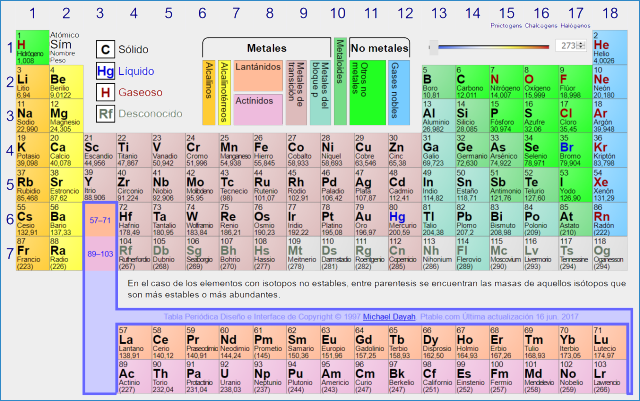
La ordenación de estos elementos en función de sus propiedades físicas y químicas, da lugar a la llamada “Tabla Periódica”. Fue ideada por un químico ruso llamado Mendeleiev en el año 1869. Desde aquella primera tabla que contenía tan sólo 63 elementos hasta la actual que tiene más de 112, se han publicado más de setecientas. La mayoría mantienen el formato clásico, pero también las hay con representaciones bien curiosas, según que incidan en algún aspecto concreto como, por ejemplo, los elementos necesarios para la vida. Existe incluso una tabla futurista que prevé, con todas las reservas, los nuevos elementos que se pueden llegar a crear. Rusos, alemanes y norteamericanos, compiten en la carrera por conseguirlos, una competencia que a menudo genera polémica
Compuestos
Compuestos Inorgánicos
Se agrupan en los óxidos, ácidos, bases y sales. Los óxidos provienen de la combinación del óxido con un metal o no-metal; los ácidos provienen de la unión de un óxido no-metálico con agua. Por eso, estos óxidos se llaman también óxidos ácidos, hay ácidos que provienen de la unión de un no-metal con hidrógeno; las bases o hidróxidos provienen de la unión de un óxido metálico con agua. Hay bases que provienen de la unión de un metal con agua; las sales provienen de la unión de un ácido con base o de un metal con un ácido.
Compuestos Orgánicos
Son muy variados y mas abundantes que los inorgánicos. Ejemplos: hidrocarburos, proteínas, carbohidratos; lípidos, vitaminas, alcoholes, ácidos orgánicos, ésteres y otros. Todos ellos son muy usados en la elaboración de utiles escolares, alimentos, medicinas, prendas de vestir, combustibles, pinturas, etc.
Descargar PDF ►Tabla Periódica
Versión Interactiva ►Tabla Periódica
Clasificación de los Metales
Metales alcalinos (IA)
Comprenden seis elementos (Li, Na, K, Rb, Cs, y Fr), en el que no esta incluido el hidrógeno. Son elementos de alto carácter metálico, sólidos de baja densidad, blandos, de puntos de fusión relativamente bajos y altamente reactivos con respecto al resto de los metales
Metales alcalinotérreos (IIA)
Comprenden seis elementos (Be, Mg, Ca, Sr, Ba, y Ra). Se caracterizan por ser sólidos, menos metálicos y menos reactivos que los metales alcalinos, pero mas densos, mas duros y con mayor punto de fusión que estos.
Metales de transición (IB al VIIIB)
Muchos metales preciosos y de gran utilidad pertenecen a este grupo, entre ellos están : Au, Ag, Fe, Ni, Zn y Cu. Este grupo se caracteriza en general por tener alta densidad, alto punto de fusión (excepto el Hg) y una reactividad química muy diversa
Metales de transición interna
Son un subgrupo de los metales de transición pertenecientes a dos series:
Serie de los lantánidos: tienen propiedades similares a la del lantano, y son por lo general blandos, de color gris y buenos conductores de la electricidad.
Serie de los actínidos: tienen propiedades similares a la del actinio, y presentan también propiedades radioactivas. Los actínidos son números atómicos superiores al uranio, no existen en forma natural por que tienden a desintegrarse radiactivamente con facilidad , por lo que se sintetizan en reactores nucleares.
Metales de los grupos IIA al VIA
Comprenden algunos semimetales o metaloides. Los metales son el Al, Ga, In, Tl, Ge, Sn, Pb, Bi y Po y los metaloides son el B, Si, As, Sb, Te, y At.
Propiedades Químicas de Metales
Algunas reacciones químicas de los metales son: la formación de óxidos básicos, de bases y sales, además de la prueba de llama.
La formación de óxidos básicos ocurre cuando un metal reacciona con el oxígeno. Uno de los casos mas conocidos es la formación de herrumbre (óxido de hierro) durante la oxidación lenta del hierro. En el caso de los metales alcalinos la reacción es violenta.
La formación de bases o hidróxidos ocurre cuando un metal alcalino reacciona directamente con el agua. Esta reacción es muy violenta para estos metales, particularmente en el caso del sodio para formar hidróxido de sodio.
La formación de sales ocurre cuando un metal reacciona con un ácido liberando el gas hidrógeno. Los metales alcalinos reaccionan en forma explosiva, por lo que se debe evitar su contacto con ácidos, un metal también puede reaccionar con una sal para formar otra sal desplazando el otro metal. Es necesario que el nuevo metal sea mas activo que el metal que forma parte de la sal para poder desplazarlo.
Clasificación de los No Metales
Los no – metales están ubicados en los grupos IVA al VIIIA, conocidos como los grupos del carbono, del nitrógeno, del oxígeno, de los halógenos y de los gases nobles. El hidrógeno es considerado un caso particular en cuanto a su ubicación en la tabla periódica.
El hidrógeno
Es el elemento mas pequeño que existe. No se puede ubicar correctamente en ningún grupo de la tabla periódica debido a sus propiedades particulares. Algunas veces aparece ubicado en el grupo IA debido a su parecido a los metales alcalinos a nivel de su estructura electrónica, aunque no es un metal. El hidrógeno también se comporta como un no – metal. Es incoloro y gaseoso a temperatura ambiente y tiene una amplia reactividad química tanto con metales como no – metales.
Carbono
grupo IVA. Comprende elementos no metálicos, semimetalicos y metálicos. El carácter metálico aumenta dentro del grupo de arriba hacia abajo a medida que crece el numero atómico. Así tenemos que el carbono es un no – metal, el silicio y el germanio son metaloides, pero el estaño y el plomo son metales. El carbono y el silicio son los mas abundantes en la naturaleza: el carbono es el constituyente básico de la materia viva, mientras que el silicio es el elemento básico constituyente de la corteza terrestre.
Nitrógeno
Grupo VA. Comprende los no metales, nitrógeno y fósforo, los semimetales arsénico y antimonio, y el metal bismuto. el nitrógeno y el fósforo no son metales muy importantes en la naturaleza y forman una gran variedad de compuestos debido a su gran capacidad de oxidación.
Halógenos
Grupo VIIA. Comprende solo no metales llamados flúor, cloro, bromo, yodo y astato. Este último, preparado en forma artificial en 1940, es radiactivo y poco conocido. Este grupo es muy reactivo, especialmente con los metales alcalinos y los alcalinotérreos con los que forman sales. La reactividad aumenta a medida de que decrece su numero atómico. No se encuentran en estado libre en la naturaleza, sino combinado formando diversos compuestos.
Gases nobles o inertes
Grupo VIIIA o grupo cero. Comprende solo no metales gaseosos llamados helio, neón, argón, kriptón, y radón. Son poco reactivos, aunque en 1962 se sintetizaron algunos compuestos de xenón y radón y kriptón con flúor u oxígeno. Su poca reactividad se debe a su estabilidad electrónica.
Propiedades Químicas de los No Metales
Algunas reacciones importantes de los no metales que se deben considerar son: formación de óxidos ácidos, de ácidos, de sales y de diversos compuestos.
La formación de óxidos ácidos o no metálicos llamados también anhídridos, ocurre cuando un no metal reacciona con el oxígeno. Algunos de ellos son el monóxido de carbono, el dióxido de nitrógeno, el dióxido de azufre, el trióxido de azufre, y los óxidos de los halógenos como el trióxido de cloro.
La formación de ácidos (hidrácidos) ocurre cuando los halógenos o el azufre reaccionan con el hidrógeno. Algunos de esos ácidos son el ácido clorhídrico, el ácido sulfhídrico, el ácido bromhídrico, etc. Los hidrácidos no contienen oxígeno.
La formación de sales de tipo haloideas ocurre cuando un no metal reacciona con un metal. Esto ocurre principalmente entre los halógenos y los metales. Algunas sales son cloruro de sodio, bromuro de potasio, fluoruro de litio, cloruro de calcio, etc. Las sales haloideas no contienen oxígeno.
La formación de diversos compuestos ocurre cuando los no metales reaccionan entre sí. Entre estos se encuentran el agua, el metano, el oxígeno molecular, el amoniaco, y otros.
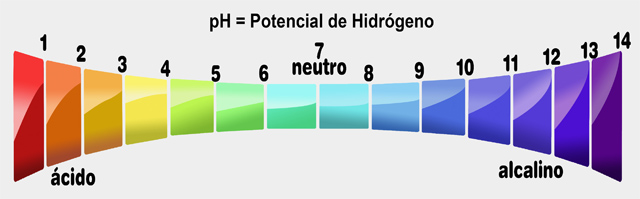
Acidez y Alcalinidad
La acidez y alcalinidad responden a la forma de clasificar la reacción de cualquier elemento, sobre todo en medios líquidos. El grado de acidez o alcalinidad se mide a través de una escala de pH, que va del extremo ácido 0 al extremo alcalino 14, y en el centro está el 7, el valor neutro. Las aguas naturales usualmente tienen un pH neutro entre 6,5 y 8,5.
La palabra pH es la abreviatura de “pondus Hydrogenium”. Esto significa literalmente el peso del hidrógeno. El pH es un indicador del número de iones de hidrógeno. Tomó forma cuando se descubrió que el agua estaba formada por protones (H+) e iones hidroxilo (OH-).
El pH no tiene unidades; se expresa simplemente por un número.
Cuando una solución es neutra, el número de protones iguala al número de iones hidroxilo.
Cuando el número de iones hidroxilo es mayor, la solución es básica, Cuando el número de protones es mayor, la solución es ácida.
Esta información y nuestro asesoramiento técnico, ya sea verbal, por escrito o mediante ensayos, se da de buena fe pero sin garantía. Esto también se aplica cuando los derechos de propiedad están involucrados.
El asesoramiento no lo libera de la obligación de comprobar su validez y para poner a prueba nuestros productos en cuanto a su idoneidad para el uso previsto.
El almacenamiento, la aplicación y uso de nuestros productos están fuera de nuestro control y, por tanto, exclusivamente bajo su propia responsabilidad.